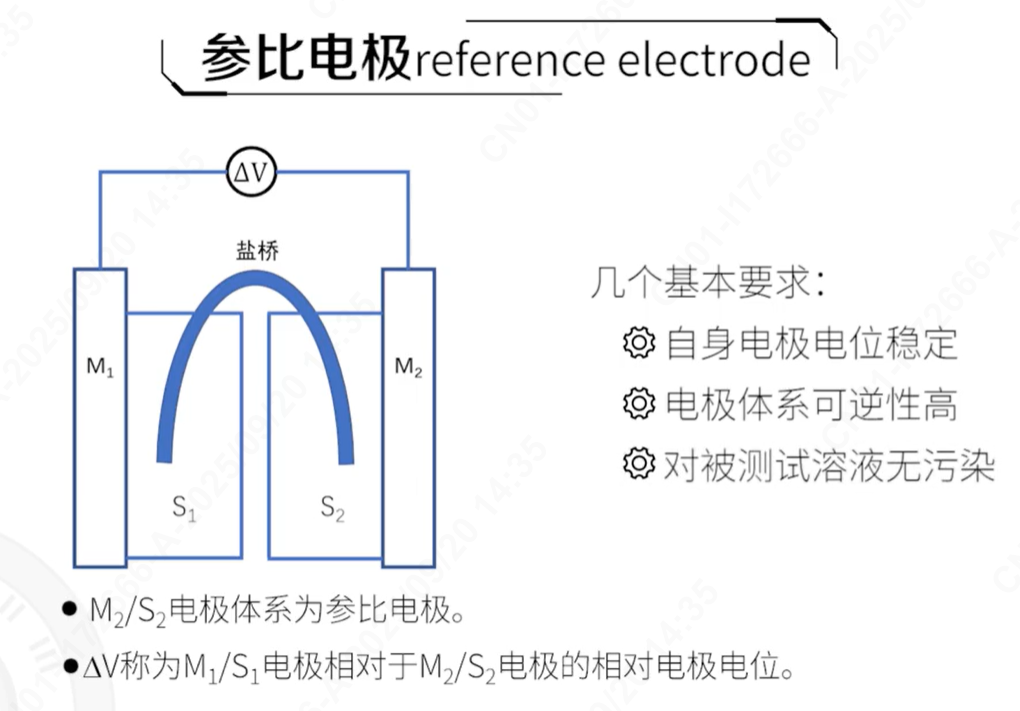
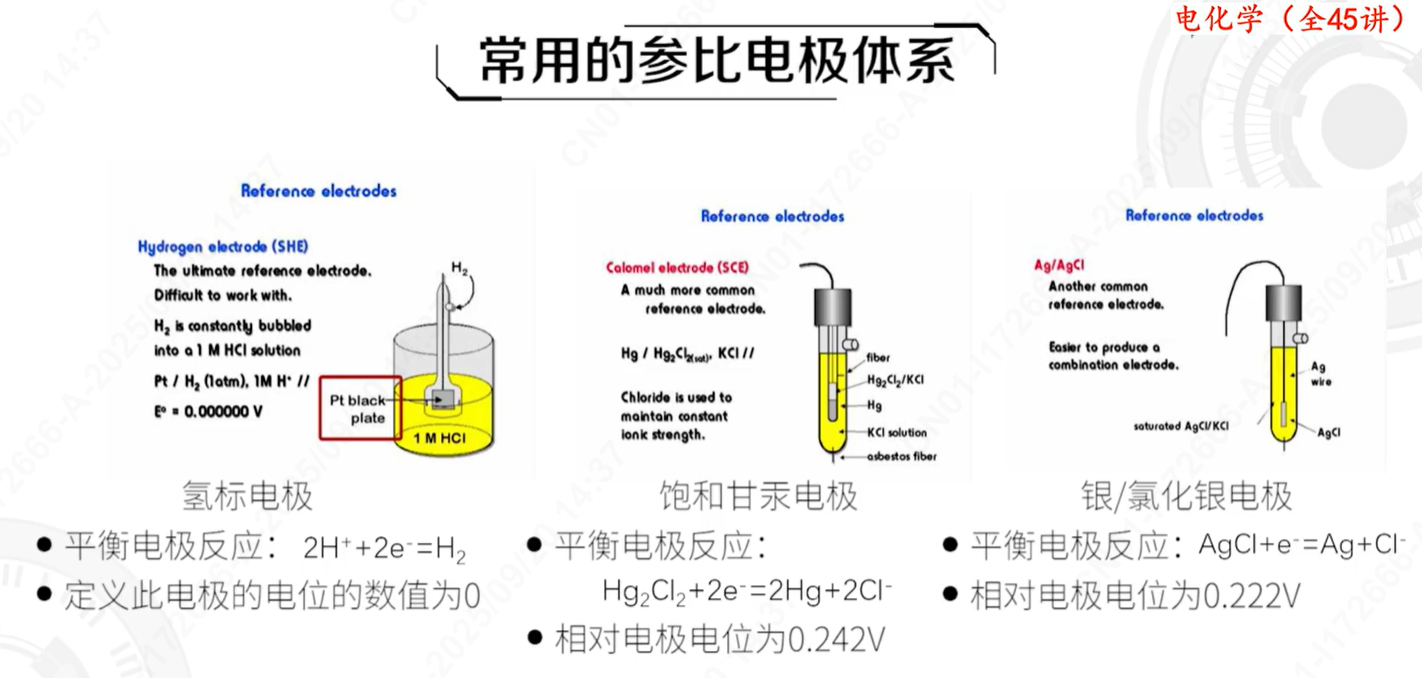
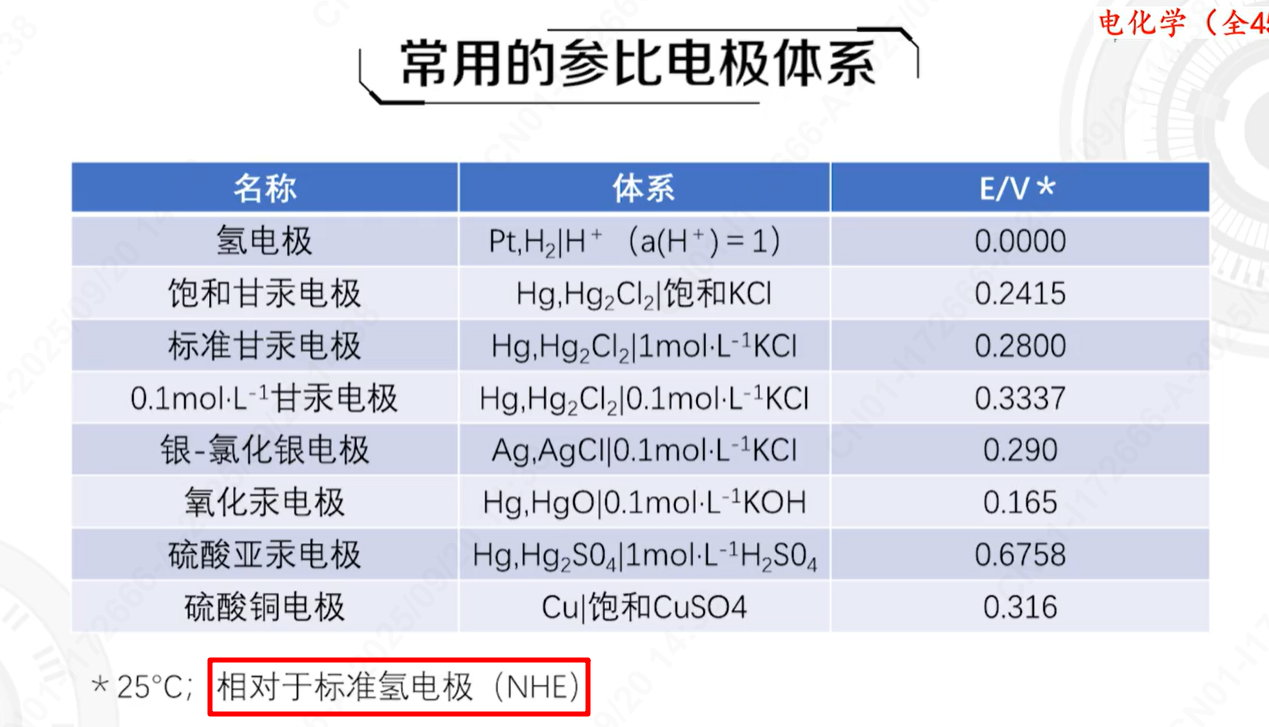
理论
绝对电极电位

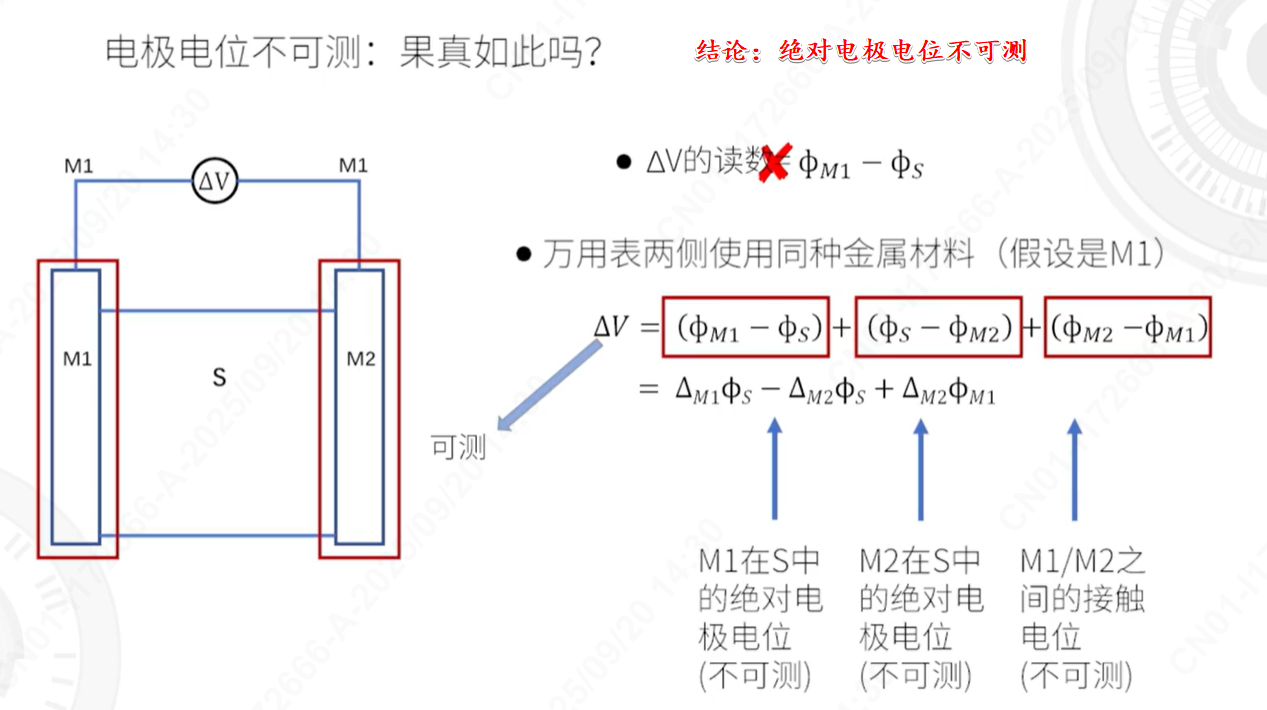
为什么绝对电极电位不可测?
- 核心概念:什么是“绝对电极电位”?
想象一下把一块金属(比如锌片)插入到它的盐溶液(比如硫酸锌溶液)中。金属表面和溶液之间会发生化学反应,形成一层特殊的电荷层(我们称之为“双电层”)。这个电荷层产生的电势差,就是这块金属在该溶液中的绝对电极电位(图中表示为 φ_M1 - φ_S 或 φ_M2 - φ_S)。
关键点: 这个电位是单一金属/溶液界面固有的属性,但我们没有任何仪器能直接伸进去测量它。 - 我们是如何测量电位的?——必须构成回路
所有电压测量仪器(如图中的万用表 ΔV)的工作原理,都是测量两个点之间的电势差。
要测量任何一个点的电位,你必须要有另一个点作为参考(就像测高度需要有海平面作为零点一样)。在电化学中,我们测量时不可避免地要形成一个闭合的电流回路。 - 示意图的分析:为什么测不到?
图中的实验试图去测量金属 M1 的绝对电极电位 (φ_M1 - φ_S)。它的设计是:
- 将万用表的两根引线都使用同一种金属材料 M1。
- 这样,万用表的一端接在容器A的M1金属上,另一端接在容器B的M1金属上。
理想情况(错误的想法):
如果我们天真地认为,万用表的两根M1导线和两个容器里的M1电极都完全一样,那么测出来的电压 ΔV 似乎就应该等于左边容器中 M1/S 的界面电位 (φ_M1 - φ_S)。
实际情况(图中的正确解释):
但事实上,整个测量回路中包含了多个不可测的界面。图中将 ΔV 的读数分解成了三部分:
- (不可测)M1在S中的绝对电极电位:(φ_M1 - φ_S)← 这本来是我们想测的目标!
- (不可测)M2在S中的绝对电极电位:(φ_S - φ_M2)← 另一个金属/溶液界面的电位,方向相反。
- (不可测)M1/M2之间的接触电位:(φ_M2 - φ_M1)← 当两种不同的金属M1和M2直接接触时(在万用表内部或接线处),由于电子逸出功不同,也会产生一个固有的电位差。
最终,万用表测到的 ΔV 是这三个不可测的电位差的代数和。 我们无法将它们分离开来,从而单独获得我们想要的 (φ_M1 - φ_S)。就像一个黑盒子,你只知道输出的总和,但不知道里面每个零件具体贡献了多少。
相对电极电位
“相对”电极电位的思想是:我们不追求测量绝对的数值,而是通过一个巧妙的设计,只测量“变化量”或“相对值”。
ΔV = Δᴍ₁φₛ - Δᴍ₂φₛ + Δᴍ₂φᴍ₁这个公式描述了图中万用表测到的总电压 ΔV是由三部分组成的:
- Δᴍ₁φₛ: 我们想研究的待测电极(金属M1/溶液S界面)的绝对电位(不可直接测)。
- Δᴍ₂φₛ: 参考电极(金属M2/溶液S界面)的绝对电位(不可直接测)。
- Δᴍ₂φᴍ₁: 参考电极的金属M2和万用表引线(金属M1)之间的接触电位(不可直接测)。
为什么它变得可测了?——锁定变量
实验的关键在于,我们精心选择并使用一个参考电极(如甘汞电极、银-氯化银电极,尤其是图中作为基准的标准氢电极SHE)。
这个参考电极具有极其重要的特性:
- Δᴍ₂φₛ保持恒定:参考电极的电位是稳定不变的,它是一个已知的、固定的值(例如我们规定标准氢电极的电位为0 V)。
- Δᴍ₂φᴍ₁是固定的:只要实验温度不变,两种不同金属(M1和M2)之间的接触电位也是一个固定的常数。
现在,我们来看这个公式的微分形式(也就是看“变化量”):d(ΔV) = d(Δᴍ₁φₛ) + 0
解读:
- d(Δᴍ₂φₛ)的变化量是 0,因为参考电极电位恒定不变。
- d(Δᴍ₂φᴍ₁)的变化量也是 0,因为接触电位是常数。
因此,万用表读数的变化量 d(ΔV)完全且唯一地来自于待测电极绝对电位的变化量 d(Δᴍ₁φₛ)。
结论:
虽然我们测不到绝对的 Δᴍ₁φₛ值,但我们可以精确地测量它的任何变化。仪器表盘上指针的每一次摆动,都直接、准确地反映了我们想研究的那个电极界面发生的化学变化。
上述内容描述了如何精确测量它的变化,但这里还有一个十分关键的问题:所要测量的“变化”是由什么引起的。这个关键问题将在后面的文章中讲述。